DVM, MS, дипл. ACVIM (SAIM и нейрология)Джон Россмейсл — младший (John Rossmeisl Jr.), Virginia-Maryland Regional College of Veterinary Medicine, Virginia, USA, Доктор Россмейсл получил степень доктора ветеринарии в Обернском университете в 1997 г.
DVM, MS, дипл. ACVIM (SAIM и нейрология)Джон Россмейсл — младший (John Rossmeisl Jr.), Virginia-Maryland Regional College of Veterinary Medicine, Virginia, USA, Доктор Россмейсл получил степень доктора ветеринарии в Обернском университете в 1997 г.
КЛЮЧЕВЫЕ МОМЕНТЫ
Приобретенные метаболические энцефалопатии (ПМЭ) — разнородная группа неврологических расстройств, характеризуемых нарушением функций головного мозга, возникающих из-за заболеваний других органов.
- Клинические признаки ПМЭ типичным образом отражают диффузное нарушение функций переднего мозга.
- Гипогликемия и печеночная энцефалопатия — самые частые причины ПМЭ у собак.
- Цереброваскулярные осложнения эндокринных и метаболических заболеваний у собак, например, инсульт, часто встречаются в практике ветеринарии мелких животных.
- Системные клинические симптомы и признаки нарушения функций органов часто наблюдаются при осмотре и в результатах лабораторных исследований у собак с ПМЭ.
- Быстрое распознавание обусловленных ПМЭ нарушений неврологических функций позволяет устранить симптомы с помощью поддерживающей терапии и соответствующего лечения основной причины данного состояния.
Введение
Ряд метаболических заболеваний могут вызывать неврологическую симптоматику у собак, а метаболические неврологические расстройства разделяют на две категории: 1) заболевания, возникающие из-за врожденных ошибок метаболизма, включая лизосомальные болезни накопления, органические ацидурии, митохондропатии и перок- сисомальные заболевания; 2) приобретенные болезни, возникающие вследствие нарушения функций или недостаточности периферических органов, которые вторично поражают нервную систему. В этом обзоре термин «приобретенные метаболические энцефалопатии» (ПМЭ) будет обозначать клинические признаки нарушения функций головного мозга, возникающие из-за заболеваний других органов. Врожденные ошибки метаболизма описываются в других источниках (1, 2).
Этиология и клинические признаки ПМЭ у собак
Этиология ПМЭ представлена в таблице 1. Две наиболее частые причины — гипогликемия и печеночная энцефалопатия (ПЭ). Среди причин гипогликемии (таблица 2) наиболее часто имеют значение паранеопластическая, транзиторная гипогликемия и передозировка инсулина (3). Врожденные портосистемные сосудистые мальформации (ВПСМ) и цирроз, обычно обусловленный хроническим гепатитом, приводящие к портальной гипертензии и развитию множественных приобретенных портосистемных коллатералей (рисунок 1), являются наиболее распространенными причинами ПЭ у собак (4).
Неврологические проявления гипогликемии и ПЭ отражают диффузное нарушение функций переднего мозга (5). Ранние клинические признаки нейрогликопении, наблюдаемые при концентрациях глюкозы в плазме крови ниже 3,5 ммоль/л (63 мг/дл), включают гипервозбудимость и тремор и обусловлены симпатическим тонусом и высвобождением катехоламинов, глюкагона и кортизола в попытке увеличить концентрацию глюкозы в плазме крови. Наиболее распространенные признаки гипогликемии и ПЭ включают угнетение сознания, таламокортикальный зрительный дефицит и генерализованные судороги (3,5). Измененное поведение, например, бесцельное хождение и прижимание головы, также часто отмечается у собак с ПЭ; иногда могут наблюдаться двусторонний миоз, ани- зокория и миоклонусы. Концентрации глюкозы ниже 1,5 ммоль/л (27 мг/дл) сопровождаются тяжелым состоянием, например, комой и летальным исходом. Клинические признаки гипогликемии и ПЭ могут быть эпизодическими, а признаки ПЭ утяжеляются после приема пищи (4, 5).
| Механизм заболевания | Примеры | Специфические причины |
| Нарушение ионного/ электролитного баланса | Гипокальциемия | • Первичный гипопаратиреоз
• Беременность и лактация |
| Гипернатриемия | • Центральный несахарный диабет
• Полиурия |
|
| Гипонатриемия | • Гипоадренокортицизм
• Гипотиреоидная микседематозная кома |
|
| Цереброваскулярные
заболевания |
Инсульт*
Гипертоническая энцефалопатия |
• Хроническая почечная недостаточность
• Сахарный диабет • Гиперадренокортицизм • Гипотиреоз • Первичная или вторичная гипертензия • Феохромоцитома |
| Нарушение функций внутренних органов | Печеночная энцефалопатия* | • Врожденные порто-системные аномалии
• Цирроз |
| Уремическая энцефалопатия | • Острая почечная недостаточность
• Хроническая почечная недостаточность |
|
| Нейрогликопения | Гипогликемия* | См. табл. 2 |
*Распространенные причины.
Таблица 2. Общие механизмы и этиология гипогликемии
| Недостаточность глюкозы | Избыточная утилизация глюкозы | Многофакторные причины |
| Голодание | Инсулинома* | Сепсис |
| Мальабсорбция | Отравление гипогликемическими препаратами | |
| Гипокортицизм | Кахексия с истощением жировой ткани | |
| Гипогликемия новорожденных | Гипогликемия охотничьих собак | |
| Транзиторная ювенильная гипогликемия* | Ятрогенная передозировка инсулина* | |
| Болезни печени* | Экстрапанкреатические новообразования* | |
| Врожденные метаболические болезни (например, болезнь накопления гликогена) |
‘Распространенные причины.
Применение магнитно-резонансной томографии (МРТ) привело к более частому распознаванию цереброваскулярных заболеваний (ЦВЗ) в ветеринарной практике. ЦВЗ -патологические изменения головного мозга, вызванные патологическим процессом, поражающим кровоток. Эндокринные и метаболические заболевания идентифицированы как факторы риска развития ЦВЗ у собак, включая хронические болезни почек (ХБП), сахарный диабет, гиперкортицизм, гипотиреоз и феохромоцитому (таблица 1) (6,7), а наиболее частым клиническим проявлением ЦВЗ является острое нарушение мозгового кровообращения (ОНМК) или инсульт (7). В отличие от других причин ПМЭ отличительным клиническим признаком ОНМК является острый дебют очагового нарушения функций головного мозга, которое перестает прогрессировать через 72 ч (7); специфический неврологический дефицит, обусловленный инсультом, связан с размером и топографией ОНМК в головном мозге (6,7). Гипертоническая энцефалопатия является еще одним сосудистым осложнением метаболических расстройств и клинически описывается диффузной мозговой симптоматикой, например, оглушением, судорогами и таламокортикальной слепотой. Гипертоническая энцефалопатия возникает у собак с тяжелой артериальной гипертензией (систолическое артериальное давление [АД] выше 200 мм рт. ст.), острым гипертоническим кризом или обоими состояниями (8).
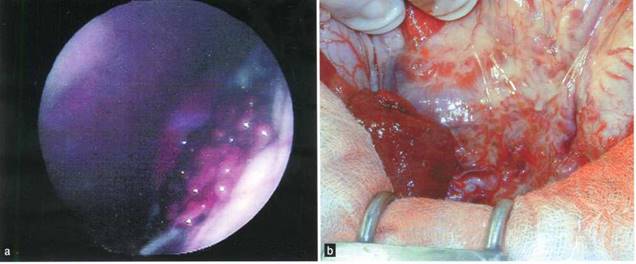
Рисунок 1. Приобретенная терминальная гепатопатия, вызвавшая печеночную энцефалопатию у собаки.
(a) Лапароскопическая картина, демонстрирующая микропеченочный и макронодулярный цирроз печения у 8-летнего кастрированного кобеля сибирской лайки, страдавшего печеночной энцефалопатией, вызванной идиопатическим хроническим циррозом.
(b) Интраоперационная картина множественных приобретенных портосистемных шунтов у 7-летней кастрированной суки смешанной породы, страдавшей печеночной энцефалопатией на фоне вызванного действием меди гепатита
Анамнестические или физикальные признаки заболевания, поражающего дополнительно к головному мозгу несколько органов, часто будут возникать у собак с ПМЭ. Изменения аппетита и состояния тела являются распространенными и могут варьировать от анорексии до полифагии и от кахексии до прибавки массы тела, соответственно. Собаки, страдающие ПЭ, обычно имеют сопутствующие признаки нарушения функций печени, включая рвоту, диарею, снижение массы тела, полиурию и полидипсию. У собак с паранеопластической гипогликемией можно прощупать объемные образования печени или кишечника, или обнаружить лимфаденопатию. Поражения
глаз могут наблюдаться у собак, страдающих артериальной гипертензией с ОНМК или гипертонической энцефалопатией; клинические признаки гипертонической ретинопатии включают кровоизлияния в переднем и заднем сегментах, отслойку сетчатки, вторичный передний увеит и (в тяжелых случаях) отек соска зрительного нерва (рисунок 2).
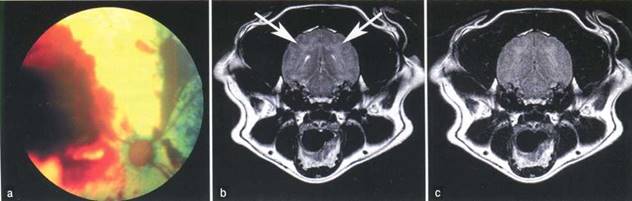
Рисунок 2. Гипертоническая ретинопатия и энцефалопатия у 9-летней кастрированной суки смешанной породы, страдавшей феохромоцитомой. Фундоскопия демонстрирует кровоизлияния и отслойку сетчатки (а). Т2- взвешенное (Ь) и FLAIR (режим с подавлением сигнала свободной воды) (с) MPT-изображения в поперечной плоскости на уровне водопровода среднего мозга; двусторонние симметричные гиперинтенсивные участки в субкортикальном белом веществе (стрелки) указывают на отек
Патофизиология ПМЭ
ПМЭ возникает вследствие изменений биохимии головного мозга, вызванных расстройствами механизмов гомеостаза. Общим патофизиологическим признаком ПМЭ является общее подавление функций головного мозга, которое обычно носит обратимый характер при устранении причины, вызвавшей ПМЭ. Однако в отсутствие лечения ПМЭ способно привести к перманентному вторичному структурному повреждению головного мозга.
Энергетический метаболизм и кровоток в головном мозге
Головной мозг является энергетически активным органом, который исключительно чувствителен к изменениям кровотока и поступлению энергии (7,9). Функционирование головного мозга зависит от постоянной доставки
кислорода и глюкозы для образования АТФ в количествах, достаточных для поддержания функций ионных насосов, синтеза, высвобождения и рециркуляции нейромедиаторов, а также других внутриклеточных метаболических функций. Несмотря на то, что головной мозг составляет 2 % от массы тела, кровоток через головной мозг составляет 15-18 % от сердечного выброса в покое, а в процессе метаболизма головной мозг потребляет 20 % от содержания кислорода в организме и 25 % глюкозы. Общим конечным фактором ишемического/гипоксического или гипогликемического повреждения головного мозга является снижение содержания энергетических субстратов (гипоксемия или гипогликемия) в крови или снижение кровотока в головном мозге (ишемия), которые падают ниже минимального порога, требуемого для поддержания нормальной работы головного мозга (9). Ишемия головного мозга заключается в снижении перфузии, гипогликемии и увеличении концентрации углекислого газа. Доставка глюкозы в головной мозг происходит с помощью облегченного градиентом концентрации транспорта, который не зависит от инсулина. Головной мозг обладает ограниченным запасом гликогена, который может мобилизироваться в лактат для обеспечения энергетических потребностей перед лицом гипогликемии (9), однако глубокая и устойчивая ишемия/гипоксия или гипогликемия в конечном итоге приведет к истощению запасов АТФ.
Как только запасы АТФ истощатся, №+,К+-АТФазные насосы станут неработоспособными и исчезнет трансмембранный ионный градиент. Это приводит к высвобождению экзотоксических нейромедиаторов, которые инициируют и потенцируют каскад биохимических реакций, в конечном итоге приводящих к некрозу головного мозга. Полная ишемия головного мозга приведет к потреблению доступного кислорода в течение нескольких секунд и истощению общей концентрации АТФ в течение нескольких минут. Для некроза нейронов от гипогликемии требуется падение концентрации глюкозы ниже приблизительно 1-1,5 ммоль/л (18-27 мг/дл) в течение 30 или более минут (9).
Клетки с более высокой скоростью метаболизма более восприимчивы к гипогликемическому или ишемическому/ гипоксическому повреждению. Нейроны в коре головного мозга, ядрах гиппокампа, мозжечка и таламуса после олигодендроглии, астроцитов и микроглии являются наиболее уязвимыми клеточными популяциями в головном мозге (7, 9).
Глобальная ишемия или гипоксия головного мозга способна возникать из-за остановки сердца или осложнений анестезии. Существует множество причин ЦВЗ, каждая из которых может приводить к очаговой ишемии. ОНМК характеризуется ишемией с инфарктом в результате окклюзии сосудов (ишемический инсульт) или без такового и кровоизлиянием, вызванным нарушением целостности сосудистой стенки (геморрагический инсульт). Потенциальная обратимость ишемического инсульта зависит от величины и продолжительности снижения кровотока. Окончательный результат необратимой ишемии — некроз (инфаркт) пораженного участка головного мозга, однако этот процесс является динамическим; инфаркт обладает центральным ядром подвергшейся тяжелой гипоперфузии ткани, которая быстро отмирает, и окружен пенумброй тканей с более умеренным снижением кровотока. В пенумбре сохраняется возможность восстановления тканей, и она является целью большей части терапевтических вмешательств (7).
Артериальная гипертензия может сопровождать различные эндокринные и метаболические заболевания, вызывающие ОНМК, включая ХБП, сахарный диабет, гиперкортицизм и феохромоцитому. Хотя патофизиология гипертонической энцефалопатии не до конца изучена, ее считают результатом нарушения миогенных церебральных ауторегуляторных механизмов, приводящих к гипоперфузиии и формированию вазогенного и интерстициального отека головного мозга (рисунок2) (8).
Печеночная энцефалопатия
Патогенез печеночной энцефалопатии многофакторный и подробно описан (4, 5, 10,11). Она возникает из-за снижения интенсивности метаболизма образующихся эндогенно токсинов, что в свою очередь обусловлено нарушением функций печени или возникновением патологических портосистемных шунтов, которые дают токсинам возможность миновать печень (5). Накопление токсинов приводит к нарушениям функций головного мозга, включая нарушение передачи сигналов между нейронами, ухудшение функций гематоэнцефалического барьера (ГЭБ) и изменения церебрального кровотока (5,10). Ни один токсин не идентифицирован как отвечающий за все изменения, наблюдаемые в головном мозге при ПЭ. В патогенезе состояния принимают участие ряд нейротоксинов, например, ароматические аминокислоты, серотонин, эндогенные бензодиазепины и марганец. Однако в центре концепции остается аммиак (11). Концепция утверждает, что гипераммониемия, возникающая из-за ухудшения функций печени и портосистемного шунтирования, является предполагаемой причиной ПЭ. При ухудшении способности печени к синтезу мочевины основным методом детоксикации аммиака становится метаболизм глутамина в астроцитах (5, 11). Таким образом, при гипераммониемии глутамин, вещество с сильными осмотическими свойствами, накапливается в астроцитах: это приводит к внутриклеточному отеку и ухудшению функций астроцитов в отношении нейротрансмиссии и поддержания целостности ГЭБ (5). Гипераммониемия приводит также к образованию активных радикалов кислорода, которые повреждают клеточную мембрану и увеличивают проницаемость мембран митохондрий, внося свой вклад в формирование отека головного мозга.
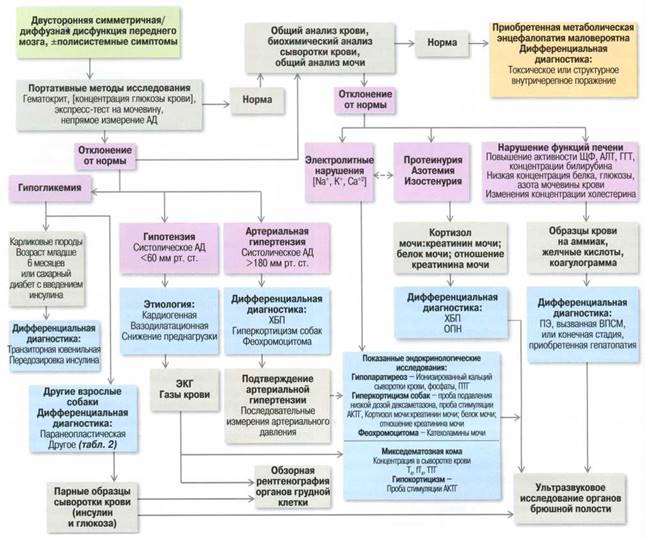
Рисунок 3. Диагностический алгоритм ПМЭ у собак. Методы исследования, требующиеся для диагностики большей части причин ПМЭ, широкодоступны и рутинно используются в ветеринарной практике
В настоящее время выявлена однонаправленная роль воспаления и инфекции в модулировании эффектов аммиака при ПЭ. На фоне гипераммониемии головной мозг сенситизируется к системно генерируемой провоспалительной цитокиновой среде, которая сопровождает многие заболевания печени, вызывающие ПЭ, что может инициировать либо усиливать воспаление или нарушение нейротрансмиссии в головном мозге. Гипераммониемия индуцирует нарушение функций нейтрофилов посредством высвобождения активных радикалов кислорода, которые вносят вклад в окислительный стресс, системное воспаление и устраняют иммунный ответ на инфекцию (10, 11).
Диагностический подход к ПМЭ
Идентификация симметричной двусторонней или диффузной неврологической дисфункции переднего мозга требует лабораторных исследований (рисунок 3) с основной целью идентификации этиологии ПМЭ. Во время ожидания результатов более сложных методов исследования обследование с применением портативных методов поможет быстро идентифицировать собак, которым требуется лечение анемии, гипопротеинемии, гипогликемии или артериальной гипотензии. Хотя существует несколько причин ПМЭ, осмотр и лабораторные исследования, как правило, обеспечивают достаточное количество дополнительной и фундаментальной информации, позволяющей прояснить дальнейший план действий в отношении применения методов исследования, а также и саму причину заболевания.
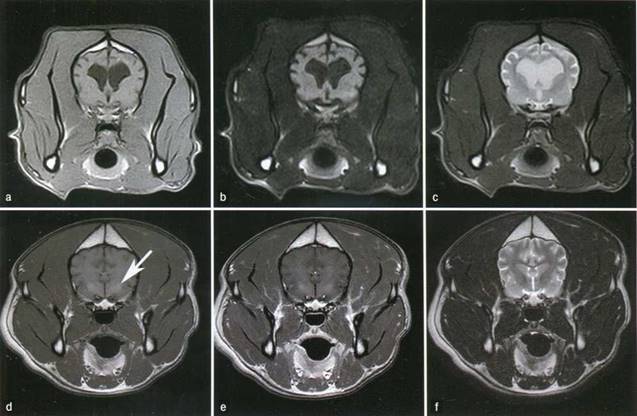
Рисунок 4. MPT-характеристики печеночной энцефалопатии, вызванной врожденными портосистемными шунтами. Верхний ряд изображений (a-с), полученных у 2-летней суки кокер-спаниеля с хроническими поведенческими изменениями, демонстрирует диффузную цереброкортикальную атрофию, которая распознается по чрезмерно глубоким и расширенным бороздам, и вентрикуломегалию боковых желудочков.
Нижний ряд изображений (d-f), полученных у 1-летнего бульдога с врожденной внутрипеченочной ВПСМ, демонстрирует двусторонние симметричные Т1 -гиперинтенсивные неконтрастные усиленные поражения в чечевицеобразном ядре (стрелка на рисунке d), В обоих рядах левые изображения — Т1 -взвешенные изображения, а правые — Т2-взвешенные изображения. Средний ряд — FLAIR-изображения, а нижнее среднее изображение — Т1 -взвешенное изображение после введения контраста
Современные визуализирующие методы исследования головного мозга не требуются в диагностике ПМЭ, за исключением ОНМК, однако MPT-характеристики ПМЭ у собак упоминаются в литературе (8, 12). У собак с ПЭ MPT-изменения могут включать цереброкортикальную атрофию, двусторонние симметричные Т-гиперинтенсивные участки в чечевицеобразном яйце, предположительно обусловленные накоплением марганца (рисунок 4) (12). Визуализирующие исследования головного мозга при ОНМК не только подтверждают диагноз, но также исключают другие заболевания с острым дебютом и очаговой дисфункцией головного мозга, например, энцефалит,
травмы и новообразования. Характеристики ОНМК при визуализирующих исследованиях подробно описаны (рисунок 5) (6, 7).
Лабораторные исследования редко приносят нормальный результату собаке ПМЭ, поэтому отсутствие изменений в ОАК, биохимическом анализе сыворотки крови и общем анализе мочи у собаки с клинической картиной диффузной или двусторонней симметричной дисфункцией переднего мозга значительно увеличивает вероятность того, что собака страдает токсической энцефалопатией или структурным поражением головного мозга.
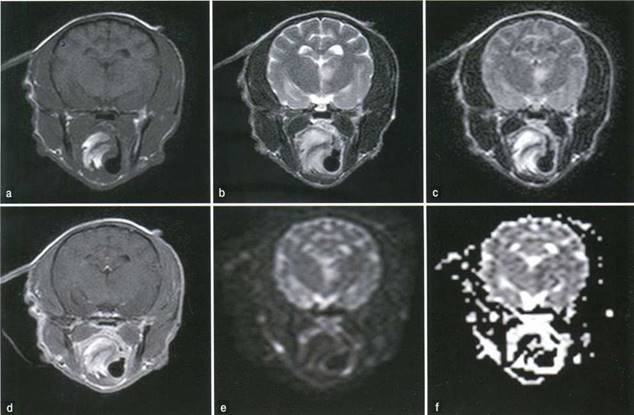
Рисунок 5. MPT-картина ишемического инсульта таламуса. Очаговое поражение находится в промежуточном мозге слева и является Т1-гипоинтенсивным (а), Т2- (Ь) и FLAIR-гиперинтенсивным (с) и не контрастируемым (d). Необратимо поврежденная область инфаркта выглядит гиперинтенсивной на диффузно-взвешенном изображении (е) и имеет вид области ослабленного сигнала на соответствующей карте внешнего коэффициента диффузии (f)
Лечение ПМЭ
Лечение включает три компонента: 1) восстановление и поддержание витальных гомеостатических функций; 2) начало специфической терапии; 3) симптоматическая терапия сопутствующих осложнений. Восстановление витальных параметров у собак с ПМЭ соответствует унифицированным принципам медицины экстренных состояний: поддержание оксигенации периферических тканей, перфузии и артериального давления. Ветеринарные врачи должны предпринять все возможные меры для достижения нормальной вентиляции, нормоволемии и нормотензии. Любые выявленные нарушения кислотно-щелочного состояния должны подвергнуться тщательной коррекции.
Отек головного мозга, который является фундаментальным событием при гипертонической энцефалопатии и осложнением гипогликемии и ПЭ, можно лечить с помощью маннитола (0,5-1,0 г/кг в/в в течение 15-30 минут) и фуросемидом (0,75-2 мг/кг в/в) (5, 8). До проведения терапии диуретиками у собак должна быть достигнута удовлетворительная гидратация и нормотензия.
Гипогликемия
Рисунок 5. MPT-картина ишемического инсульта таламуса. Очаговое поражение находится в промежуточном мозге слева и является Т1 -гипоинтенсивным (а), Т2- (Ь) и FLAIR-гиперинтенсивным (с) и не контрастируемым (d). Необратимо поврежденная область инфаркта выглядит гиперинтенсивной на диффузно-взвешенном изображении (е) и имеет вид области ослабленного сигнала на соответствующей карте внешнего коэффициента диффузии (f
Острые гипогликемические кризы лечат с помощью 50 % раствора глюкозы (0,5-1,0 г/кг, разведенные в отношении 1:4 с 0,9 % раствором натрия хлорида, в/в в течение 1 -5 минут) с последующей внутривенной инфузией 2,5-
5,0 % раствора глюкозы для поддержания эугликемии. Внутривенное введение глюкагона (5-15 нг/кг в минуту с постоянной скоростью введения) демонстрирует эффективность в поддержании эугликемии у собак с инсулиномами или другими причинами рефрактерной гипогликемии (13). У собак с транзиторной ювенильной или рецидивирующей субстрат-ограниченной гипогликемией эффективно частое кормление высокоэнергетическими кормами, например, для щенков или применяемыми при реконвалесценции.
Печеночная энцефалопатия
Хирургическая коррекция врожденной ВПСМ является потенциально излечивающим вмешательством, тогда как в рамках лечения ПЭ, вызванной приобретенным заболеванием печени на конечной стадии, главным образом, носит паллиативный характер. Устранение или предупреждение любых факторов, которые достоверно провоцируют ПЭ, например, дегидратация, желудочно-кишечное кровотечение, запор, гипокалиемия, инфекции и прием метаболизируемых печенью препаратов, носит ключевой характер (4, 5). Фундаментальная роль аммиака в патофизиологии ПЭ становится очевидной из того факта, что большая часть эффективных методов уменьшают выработку или всасывание аммиака.
Изменение питания имеет первостепенное значение в лечении ПЭ (14), поскольку образование аммиака в кишечнике можно значительно снизить с помощью корма, сбалансированного по составу, но имеющего ограниченное содержание белка, например, разделенные на несколько приемов готовые корма с низким содержанием белка, используемые при заболеваниях печени.
Содержание эндогенных и пищевых аммиак-образующих веществ можно снизить путем назначения очищающих клизм или невсасываемых дисахаридов, например, лактулозы (0,5-1,0 мл/кг внутрь раз в 8 часов). Лактулоза обладает слабительным эффектом и снижает pH толстой кишки, приводя к формированию неблагоприятной для уреазо-продуцирующих бактерий среды. Закисление толстой кишки снижает всасывание аммиака путем удержания ионов аммония в просвете кишечника. Рекомендуется также назначение антибиотиков, спектр которых включает уреазо-продуцирующую микрофлору, например, неомицин (10-20 мг/кг внутрь каждые 8-12 часов), амоксициллин (22 мг/кг внутрь каждые 8 часов) или метронидазол (7,5-15 мг/кг внутрь каждые 12 часов).
Судороги, сопровождающие ПЭ, можно лечить с помощью леветирацетама (20-40 мг/кг внутрь, п/к или в/в каждые 8 часов) или калия бромидом (30-40 мг/кг внутрь раз в сутки). Согласно результатам одного исследования, предварительная терапия леветирацетамом, как минимум, за один день до хирургического вмешательства снижает риск судорог и смерти в послеоперационном периоде при вне- печеночных ВПСМ (15). >
ОНМК и гипертоническая энцефалопатия
Собаки с клиническими признаками или признаками ЦВЗ по результатам визуализирующих исследований должны быть обследованы на артериальную гипертензию, а также предрасполагающие заболевания (6). Цели лечения собак с ОНМК состоят в поддержании церебрального кровотока и нормальной вентиляции для сохранения жизнеспособности тканей в области ишемической пенумбры (7). В настоящее время отсутствуют доказательства преимуществ тромболитической терапии у ветеринарных пациентов, страдающих ОНМК, кроме случаев наличия показаний, связанных с предрасполагающим состоянием; у большинства собак с ОНМК клиническое улучшение на фоне поддерживающей терапии будет наблюдаться в течение 2-4 недель.
Антигипертензивная терапия показана при артериальной гипертензии (систолическое АД >160 мм рт. ст. или диастолическое АД >95 мм рт. ст.) у собак с признаками энцефалопатии. Эналаприл (0,5 мг/кг внутрь каждые 12-24 часа) или амлодипин (0,1-0,2 мг/кг внутрь раз в сутки) могут быть эффективны каждый сам по себе или в сочетании (8). Острое и часто тяжело протекающее (систолическое АД ^200 мм рт. ст.) повышение артериального давления, сопровождаемое гипертонической энцефалопатией, обязывает применять антигипертензивные препараты с быстрым началом действия. Ввиду их антигипертензивного и противоотечного эффектов может применяться гидралазин (0,1-0,2 мг/кг в/в или в/м раз в 2-4 часа по мере необходимости) или эсмолол (50-75 мкг/кг в минуту в/в с постоянной скоростью введения) в сочетании с фуросемидом (0,75-2 мг/кг в/в раз в 8-24 часа). Собак, получивших лечение этими препаратами, требуется внимательно наблюдать во время терапии в отношении развития гипотензии. Феноксибензамин (0,25 мг/кг внутрь раз в 8-12 часов) является наиболее предпочтительным препаратом у собак с феохромоцитомой (16). Неврологический дефицит, сопровождающий гипертоническую энцефалопатию, должен приобрести положительную динамику в течение 24-72 часов от момента нормализации артериального давления (8).
Заключение
Выявление клинических признаков диффузной дисфункции переднего мозга у собак с признаками системной дисфункции органов или без таковых должно вызывать у ветеринарного врача подозрения в отношении ПМЭ и является показанием к выполнению общего анализа крови, биохимического анализа сыворотки крови и общего анализа мочи. Обобщение анамнеза, результатов осмотра и лабораторных отклонений, как правило, позволяет поставить окончательный этиологический диагноз, а при экстренной терапии, направленной на причину заболевания, и поддерживающей терапии, сфокусированной на восстановлении церебрального кровотока, доставке энергетических субстратов и обеспечении электролитного гомеостаза, неврологическая дисфункция часто обратима.
Литература
- Skelly BJ, Franklin RJ. Recognition and diagnosis of lysosomal storage diseases in the cat and dog. J Vet Intern Med 2002;16:133-141.
- Burton B. Inborn errors of metabolism in infancy: A guide to diagnosis. Pediatrics 1998; 102:e69.
- BrauerC, JambroszykM.TipoldA. Metabolic and toxic causes of canine seizure disorders: A retrospective study of 96 cases. Vet J 2011; 187:272-275.
- Rothuizen J. Important clinical syndromes associated with liver disease. Vet Clin North Am 2009;39:419-437.
- Saldago M, Cortes Y. Hepatic encephalopathy: Etiology, pathogenesis, and clinical signs. Comp Cont Educ Pract l/et2013;35:E1-E8.
- Garosi L, McConnell JE, Platt SR, etal. Results of diagnostic investigations and long-term outcome of 33 dogs with brain infarction (2000-2004). J Vet Intern Med 2005; 19:725-731.
- Garosi LS, McConnell JF. Ischaemic stroke in dogs and humans; a comparative review. J Small Anim Pract 2005;46:521 -529.
- O’Neill J, Kent M, Glass EN, etal. Clinicopathologic and MRI characteristics of presumptive hypertensive encephalopathy in two cats and two dogs. J Am Anim Hosp Assoc 2013 Nov-Dec;49(6):412-20,
- Auer RN. Hypoglycemic brain damage. Metab Brain Dis 2004;19:169-175.
- Seyan AS, Hughes RD, Shawcross DL. Changing face of hepatic encephalopathy: role of inflammation and oxidative stress. World J Gatroenterol 2010; 16:3347-3357.
- Shawcross DL, ShabbirSS, Taylor NJ, etal. Ammonia and the neutrophil in the pathogenesis of hepatic encephalopathy in cirrhosis, Hepatoiogy 2010;51:1062-1069.
- Torisu S, Washizu M, Hasegawa D, etal. Brain magnetic resonance imaging characteristics in dogs and cats with congenital portosystemic shunts. Vet Rad Ultra 2005;46:447-451.
- Fischer JR, Smith SA, Harkin KR. Glucagon constant rate infusion: A novel strategy for the management of hyperinsulinemic-hypoglycemic crisis in the dog. J Am Anim Hosp Assoc 2000;36:27-32.
- Proot S, Biourge V, Teske E, etal. Soy protein isolate versus meat-based low-protein diet for dogs with congenital portosystemic shunts. J Vet Intern Med 2009;23:794-800.
- Fryer KJ, Levine JM, Peycke LE, etal. Incidence of postoperative seizures with and without levetiracetam pretreatment in dogs undergoing portosystemic shunt attenuation. J Vet Intern Med 2011 ;25:1379-1384.
- Herrera MA, Mehl ML, Kass PH, etal. Predictive factors and the effect of phenoxybenzamine on outcome of dogs undergoing adrenalectomy for pheochromocytoma. J VetlntMed 2008;22:1333-1339.